Moléculas constituídas por átomos de hidrogénio e de carbono, unidos por ligações covalentes.
C6: 2 - 4 -> eletrão de valência H1: 1 -> eletrão de valência
Notação de Lewis:
x
x C x H x
x
Classificações:
Alcano: Quando tem ligação covalente entre átomos de carbono simples.
Alceno: Quando tem ligação covalente entre átomos de carbono dupla.
Alcino: Quando tem ligação covalente entre átomos de carbono tripla.
Nomes do hidrocarbonetos:
Prefixo: Quantidade de carbono:
met -> 1C
et -> 2C
prop -> 3C
but -> 4C
pent -> 5C
hex -> 6C
Alguns exemplos:
 |
| Propano: C3H8 |
São conhecidos alguns milhares de hidrocarbonetos. As diferentes características físicas são uma consequência das diferentes composições moleculares. Contudo, todos os hidrocarbonetos apresentam uma propriedade comum: oxidam-se facilmente liberando calor.
Ligações intramoleculares e intermoleculares:
Ligações moleculares intermoleculares são bastante mais fracas que os ligações intramoleculares (que são bastante fortes).
Ligações intramoleculares: Ligações existentes entre os átomos constituintes.
(ou ligações covalentes) -> estabelece-se entre os átomos para formar a molécula
dentro <- intramolecular
Ligações intermoleculares: Ligação estabelecida entre as moléculas.
dentro <- intramolecular
Ligações intermoleculares: Ligação estabelecida entre as moléculas.
fora <- intermolecular
Exemplo: Ligações por pontes de hidrogénio. -> ocorrem na água.
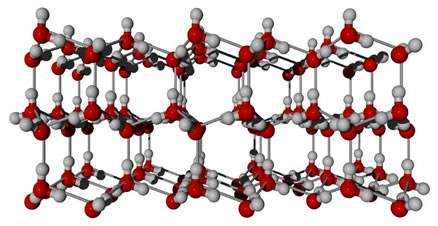

As moléculas de água, na estrutura do gelo ocupam posições mais ou menos fixas com grandes espaços entre si.
As moléculas ocupam maior espaço no estado sólido, ou seja, têm menor densidade.
E é por isso que a garrafa de água rebenta no congelador, a sua densidade diminui, consequentemente aumentando o seu volume.



Sem comentários:
Enviar um comentário