Reação com ácidos
O ouro é um exemplo de metal que sofre esse tipo de reação, mas possui uma condição: não reage com ácidos isolados. Para que o ataque aconteça é preciso uma mistura de ácidos, é a chamada água régia. Esta solução se forma da junção de ácido clorídrico (HCl) e ácido nítrico (HNO3).
Au (s) + 3 HNO3 (aq) + 4 HCl (aq) → HAuCl4 (aq) + 3 H2O (l) + 3 NO2 (g)
Reação com água
A água reage com alguns metais originando como produto gás hidrogênio (H2) e hidróxido de sódio (NaOH). Estes metais são pertencentes à classe de Metais alcalinos e Metais alcalino-terrosos, como: Lítio (Li), Bário (Ba), Césio (Cs), Potássio (K), Rádio (Ra), Cálcio (Ca), Estrôncio (Sr), entre outros.
Equação do processo:
2 Ba (s) + 2 H2O (l) → 2 BaOH (aq) + H2 (g)
Reação com bases
Somente alguns metais possuem a propriedade de reagir com bases, são eles: Zinco (Zn), Chumbo (Pb), Estanho (Sn), Alumínio (Al).
Zn (s) + 2 NaOH (aq) → Na2ZnO2 (aq) + H2 (g)
O produto sendo um Sal e Gás Hidrogênio.
Algumas reações:
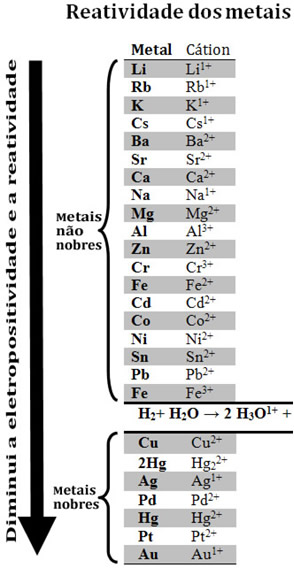
A reatividade química dos metais varia com sua eletropositividade*, logo, quanto mais eletropositivo for o elemento, mais reativo será o metal. Os metais mais reativos são aqueles que possuem grande tendência a perder elétrons, logo, formam íons positivos com mais facilidade.
*A eletropositividade também é denominada de caráter metálico, é uma propriedade periódica que relaciona a tendência de um átomo em perder eletrões.
Como por exemplo: colocando-se uma lâmina de ferro em uma solução de sulfato de cobre (II), verifica-se que a lâmina de ferro fica recoberta por uma camada de metal vermelho (o cobre). Por outro lado, a solução fica amarela (solução de sulfato de ferro II).
Isto acontece por que de acordo com a equação abaixo, a reação de deslocamento entre o elemento químico ferro (Fe) e o sulfato de cobre (CuSO4), formando-se o sulfato de ferroso (FeSO 4) e o metal cobre (Cu).
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
A ocorrência desta reação faz-nos concluir que o metal ferro é mais reativo do que o metal cobre, pois o ferro é capaz de deslocar o cobre de seu composto inicial.
Por meio de reação deste tipo, os metais podem ser ordenados por meio das reatividades químicas dos mesmos.
A reatividade química dos não-metais varia com a eletronegatividade; logo, quanto mais eletronegativo* for o elemento, mais reativo será o não-metal. Os não-metais mais reativos são aqueles que possuem grande tendência de receber eletrõs, logo, formam íons negativos com mais facilidade.
*Eletronegativo: átomo com maior capacidade de atrair eletrões para si.
Como por exemplo, o gás flúor (F2), por meio de uma reação de deslocamento, reage quimicamente com o ácido clorídrico (HCl), formando ácido fluorídrico (HF) e gás cloro (Cl2), em virtude do não-metal flúor ser mais reativo do que o não-metal cloro.
F2(g) + 2HCl(g) → 2HF(g) + Cl2(g)
Os não-metais, por meio de reações de deslocamento deste tipo, também podem ser organizados de acordo com sua reatividade.
O ouro (Au) é o menos reativo de todos os metais. Esse é um dos motivos de ele ser tão valioso, pois ele resiste ao ataque de ácidos isolados, sendo atacado somente por água régia, que é uma mistura de três partes de ácido clorídrico com uma parte de ácido nítrico.
Sem comentários:
Enviar um comentário